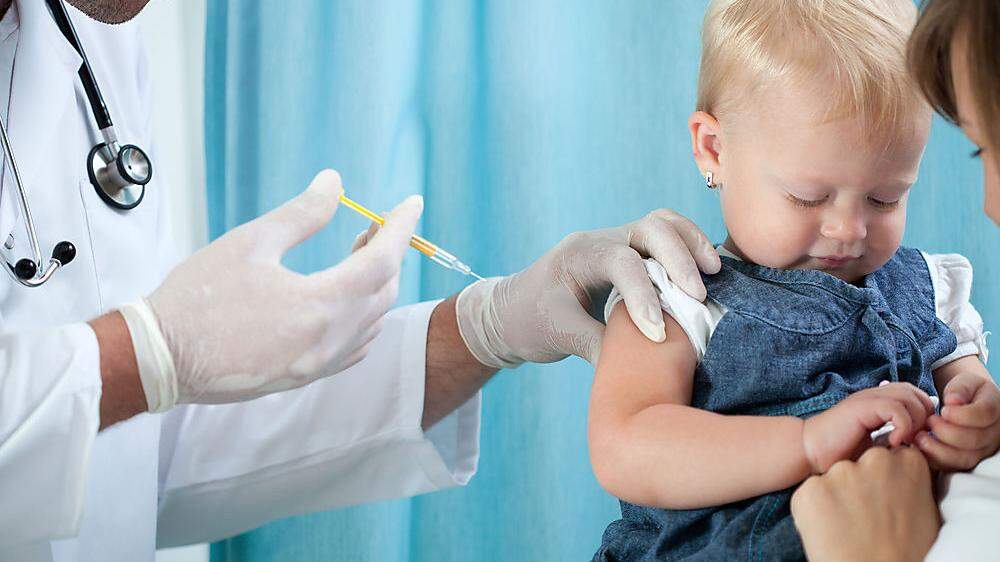
Die Pharmaunternehmen BionTech und Pfizer haben eine Notfallzulassung für ihren Corona-Impfstoff in den USA für Kinder unter fünf Jahren beantragt. Das Vakzin soll für Kinder im Alter von sechs Monaten bis einschließlich vier Jahren eingesetzt werden können, teilten BionTech/Pfizer am Dienstag mit. Im Falle einer Zulassung durch die US-Arzneimittelbehörde FDA wäre der Impfstoff der erste, der in dieser Altersgruppe erhältlich wäre. Der Antrag bezieht sich derzeit auf zwei Dosen des Vakzins. Dies gebe den Eltern "die Möglichkeit, mit einer Covid-19-Impfung für ihre Kinder zu beginnen, während sie auf die mögliche Genehmigung einer dritten Dosis warten", erklärte Pfizer.
Somit könnte das Vakzin für diese Altersgruppe womöglich bis Ende Februar zur Verfügung stehen. Dies berichtete die "Washington Post" unter Berufung auf Insider. Die FDA habe die Unternehmen aufgefordert, den Antrag einzureichen, damit die Behörde mit der Prüfung der Daten beginnen könne, hieß es.
Studie wird um dritte Dosis erweitert
Die Mainzer Biontech und ihr US-Partner Pfizer hatten Mitte Dezember mitgeteilt, dass sie ihre Studie zum Einsatz des Impfstoffs bei Kindern im Alter von sechs Monaten bis unter fünf Jahren um die Verabreichung einer dritten Impfdosis mindestens zwei Monate nach Erhalt der zweiten Dosis erweitern werden. Grund dafür waren erste Daten, wonach die Wirksamkeit nach zwei Dosen bei sechs bis 24 Monate alten Kindern zwar vergleichbar war zu der bei 16- bis 25-Jährigen. Bei Kindern von zwei bis unter fünf Jahren war dies aber nicht der Fall, weshalb nun eine dritte Dosis zur Erhöhung der Wirksamkeit getestet wird.
Bei erfolgreichem Verlauf der Studie mit drei Dosen wollen Biontech und Pfizer den Behörden in der ersten Hälfte dieses Jahres Daten zur Unterstützung einer Notfallzulassung für Kinder unter fünf Jahren vorlegen, wie die beiden Hersteller angekündigt hatten. Die FDA drückt dem Bericht zufolge aber aufs Tempo. "Wir wissen, dass zwei Dosen nicht ausreichen, und wir verstehen das", zitierte die "Washington Post" einen Insider. "Die Idee ist, dass wir mit der Überprüfung von zwei Dosen beginnen sollten." So könnte man mit der Impfung schon früher starten, als wenn man warte, bis die Daten zur dritten Dosis vorlägen. Es werde erwartet, dass die Berater der FDA Mitte Februar über den Antrag mit zwei Dosen beraten werden.
Die Dosierung bei Kindern unter fünf Jahren
In der Studie erhalten die Babys und Kleinkinder eine geringere Dosis von drei Mikrogramm pro Impfung. Kinder im Alter von fünf bis zwölf Jahren bekommen zwei Dosen von je zehn Mikrogramm. Ab zwölf Jahren liegt die Dosierung wie bei Erwachsenen bei 30 Mikrogramm pro Dosis. In der EU wurde der Einsatz des Vakzins ab zwölf Jahren im vergangenen Mai freigegeben und im November ab fünf Jahren. Zudem hatte Anfang Jänner die FDA bereits die Auffrischungsimpfung für Kinder ab zwölf Jahren erlaubt. Außerdem erlaubte sie eine Drittimpfung für Kinder zwischen fünf und elf Jahren mit einem stark geschwächten Immunsystem.