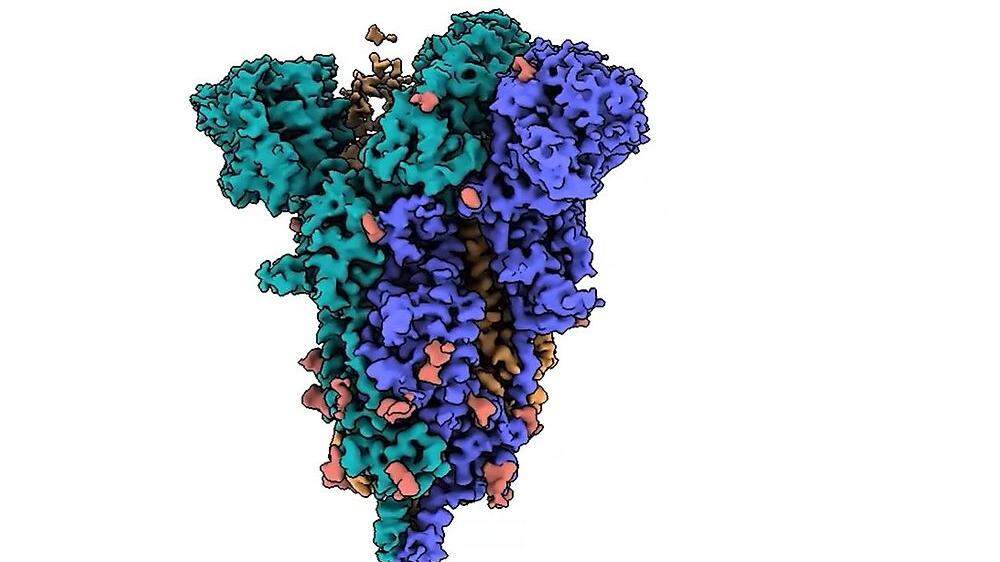
Forschende aus Lausanne ist es gelungen die Konfiguration des Spike-Proteins der Omikron-Variante auf nahezu atomarer Ebene zu beobachten. Dies dürfte neue Erkenntnisse über die Mechanismen liefern, mit denen sich die Variante Impfstoffen und Antikörpern entzieht. Möglich gemacht haben das Hochleistungselektronenmikroskope des Dubochet Center for Imaging (DCI) an der ETH Lausanne (EPFL).
Das DCI hat ein Bild des Spike-Proteins des Originalvirus mit einer Auflösung von 2 Å - der höchsten bisher erreichten Auflösung – erstellt, mit dem die Wissenschaftlerinnen und Wissenschaftler einzelne Atome betrachten konnten. "Wir können nun genau sehen, welche Mutationen der Omikron-Variante erlauben, dem Impfstoff von AstraZeneca vollständig und dem von Pfizer teilweise zu widerstehen", sagte Henning Stahlberg, der das DCI auf dem Campus der EPFL eingerichtet hat, in einer Aussendung vom Donnerstag.
Mithilfe der hochauflösenden elektronenmikroskopischen Bilder können die Wissenschaftlerinnen und Wissenschaftler besser verstehen, wie das mutierte Spike-Protein an die zellulären ACE2-Rezeptoren bindet, die es dem Virus ermöglichen, in menschliche Zellen einzudringen. Dieses Wissen könnte dazu beitragen, den Weg für neue therapeutische Ansätze zu ebnen.
"Die Bestimmung der Struktur des Omikron-Spike-Proteins weniger als einen Monat nach der ersten Identifizierung dieser Variante ist wie die Landung auf einem Planeten in den Wochen nach seiner ersten Beobachtung durch ein Teleskop", wird Didier Trono zitiert. "Das Potenzial dieser Technologie ist einfach unglaublich!"
Die noch nicht begutachtete Strukturanalyse wurde am Mittwoch auf der Open-Access-Plattform bioRxiv.org unter der Zugriffsnummer BIORXIV/2021/474250 veröffentlicht. Wissenschaftlerinnen und Wissenschaftler auf der ganzen Welt können sie für ihre eigene Forschung nutzen, um zu untersuchen, wie die Omikron-Variante auf bestehende Medikamente reagiert.